Haletos Orgânicos
Os Haletos Orgânicos são também denominados de derivados halogenados porque são compostos que se originam dos hidrocarbonetos pela substituição de átomos de hidrogênio por igual número de átomos de halogênio (F, Cl, Br, I). Esses elementos são chamados de Halogênios por que esta é a classe a que pertencem na tabela Periódica.
Propriedades químicas dos Haletos: Os haletos são altamente reativos e por isso são empregados como matéria-prima para preparar compostos orgânicos.
Veja agora as propriedades físicas dos Haletos:
1. Encontram-se em condições ambientes nas fases sólida, líquida ou gasosa;
2. Na fase líquida são incolores, com alta toxicidade e com cheiro agradável;
3. São solúveis em solventes orgânicos e insolúveis em água;
4. Apresentam pontos de fusão e ebulição crescentes com o aumento da massa molecular;
De acordo com o número de halogênios na molécula, os haletos podem se classificar em monoaletos, dialetos e trialetos. Veja abaixo a definição e a estrutura molecular para cada classificação:
Monoaleto: Apresenta somente um átomo de halogênio na molécula.
H3C ─ CH2─ CH2 ─ CH2 ─ CH2
│
Cl
1- cloro-pentano
Dialeto: Possuem dois átomos de halogênio na molécula.
H
│
H3C ─ C ─ Br
│
Br
1,1- dibromo-etano
Trialeto: Presença de três átomos de halogênio na molécula.
F
│
H ─ C ─ F
│
F
trifluor-metano
Os haletos com estrutura molecular mais simples como o Bromometano e o cloroetano, por exemplo, se encontram na fase gasosa, os haletos com estrutura mais longa são líquidos e aqueles com massa molecular elevada são sólidos.
Propriedades químicas dos Haletos: Os haletos são altamente reativos e por isso são empregados como matéria-prima para preparar compostos orgânicos.
Veja agora as propriedades físicas dos Haletos:
1. Encontram-se em condições ambientes nas fases sólida, líquida ou gasosa;
2. Na fase líquida são incolores, com alta toxicidade e com cheiro agradável;
3. São solúveis em solventes orgânicos e insolúveis em água;
4. Apresentam pontos de fusão e ebulição crescentes com o aumento da massa molecular;
De acordo com o número de halogênios na molécula, os haletos podem se classificar em monoaletos, dialetos e trialetos. Veja abaixo a definição e a estrutura molecular para cada classificação:
Monoaleto: Apresenta somente um átomo de halogênio na molécula.
H3C ─ CH2─ CH2 ─ CH2 ─ CH2
│
Cl
1- cloro-pentano
Dialeto: Possuem dois átomos de halogênio na molécula.
H
│
H3C ─ C ─ Br
│
Br
1,1- dibromo-etano
Trialeto: Presença de três átomos de halogênio na molécula.
F
│
H ─ C ─ F
│
F
trifluor-metano
Os haletos com estrutura molecular mais simples como o Bromometano e o cloroetano, por exemplo, se encontram na fase gasosa, os haletos com estrutura mais longa são líquidos e aqueles com massa molecular elevada são sólidos.
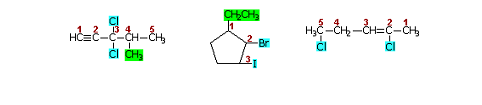
Havendo duas possibilidades iguais de numeração, em Haletos saturados, o Carbono 1 deve ser aquele que estiver no átomo de menor número atômico. Em ordem crescente de número atômico, temos Flúor, Cloro, Bromo e Iodo. Caso o Haleto seja ramificado, comece pelo menor radical. Veja então os exemplos abaixo:
Nomenclatura Usual |
Este sistema de nomenclatura é parecido com a nomenclatura de sais inorgânicos. Só é válida para compostos monohalogenados e é relativamente simples. Basta colocar o nome do Halogênio seguido do sufixo -eto (Fluoreto, Cloreto, Brometo ou Iodeto) e o nome do radical preso ao Halogênio, geralmente seguido pela letra a. Veja os exemplos:
Halogênio: Bromo | Radical: Benzila | Halogênio: Cloro | Radical: t-Butila | Halogênio: Flúor | Radical: Etila |
Brometo de Benzila | Cloreto de t-Butila | Fluoreto de Etila | |||
Classificação dos Haletos Orgânicos |
Os Haletos Orgânicos podem ser classificados de acordo com a posição e o número de Halogênios que ele contiver.
Posição dos Halogênios |
De acordo com a posição, os Haletos são classificados em geminados, vicinais ou isolados. Os Haletos geminados são aqueles que possuem pelo menos 2 Halogênios presos a um mesmo Carbono. Os vicinais são aqueles que apresentam pelo menos 2 Halogênios presos em Carbonos consecutivos e os isolados não apresentam nenhuma das duas características. Utilizando os exemplos anteriores, temos:
É importante lembrar que os Halogênios dos Haletos podem ou não ser iguais, isto não interfere em sua classificação.
Quantidade de Halogênios |
Esta classificação é simples. Um Haleto é monohalogenado quando tiver apenas uma Halogênio, dihalogenado quando tiver dois, e assim por diante.
Um haleto, também designado por halogeneto, consiste em cada um dos compostos químicos formados por um halogéneo e outro elemento químico ou radical orgânico. Quando este segundo elemento é o hidrogénio, o composto resultante é um hidrácido; quando é um metal, forma-se um sal; quando é um radical orgânico, tem-se um halogeneto orgânico, alifático ou aromático.
Os haletos podem ser formados por ligações covalentes ou por ligações iónicas. Os haletos de metais típicos são iónicos (exemplo, fluoreto de sódio, NaF). Os metais também podem formar halites nos quais a ligação é predominantemente covalente (exemplo: cloreto de alumínio AlCl3).
Os haletos de alquilo são compostos orgânicos nos quais um ou mais átomos de hidrogénio do alcano foram substituídos por átomos de halogéneo. São exemplos o clorometano (CH3Cl), o dibromometano (CH2BrCH2Br). Os haletos de alquilo podem-se formar por reacção directa entre um alcano e um halogéneo usando radiação ultravioleta.
Os haletos podem ser formados por ligações covalentes ou por ligações iónicas. Os haletos de metais típicos são iónicos (exemplo, fluoreto de sódio, NaF). Os metais também podem formar halites nos quais a ligação é predominantemente covalente (exemplo: cloreto de alumínio AlCl3).
Os haletos de alquilo são compostos orgânicos nos quais um ou mais átomos de hidrogénio do alcano foram substituídos por átomos de halogéneo. São exemplos o clorometano (CH3Cl), o dibromometano (CH2BrCH2Br). Os haletos de alquilo podem-se formar por reacção directa entre um alcano e um halogéneo usando radiação ultravioleta.
Onde são mais usados:
-> Em geral, os haletos são usados como solvente de tintas, desengraxantes para metais, composto para lavegem de roupas a seco e gás freon.
-> Em particular, o cloro-etano (C2H5Cl) é usado como anestésico, reagente na produção do chumbo-tetraetila - antidetonante para gasolina
->Alguns haletos polifluorados são usados como matéria-prima para fabricação de plásticos de alta resistência química (teflon)
-> Alguns haletos aromáticos policlorados são usados como inseticidas (BHC, DDT, lindane, dieldrin etc) (como você mesmo disse) e medicamentos (cloromicetina)
-> Em particular, o cloro-etano (C2H5Cl) é usado como anestésico, reagente na produção do chumbo-tetraetila - antidetonante para gasolina
->Alguns haletos polifluorados são usados como matéria-prima para fabricação de plásticos de alta resistência química (teflon)
-> Alguns haletos aromáticos policlorados são usados como inseticidas (BHC, DDT, lindane, dieldrin etc) (como você mesmo disse) e medicamentos (cloromicetina)





achei poucas informações sobre propriedades químicas
ResponderExcluir